他曾是“當今中國最年輕院士”,一位回歸根本👩👩👧👧、簡單純粹的科學家
2025/02/09 信息來源: 微信公眾號“生信人”
編輯:山石 | 責編😗:安寧在人體免疫系統跟病原的這場“持久戰”中,有這樣一位年輕的院士,為之作出了巨大貢獻,也是該領域的領軍人物,他就是邵峰。
他是當時中國最年輕的院士,被美國國家科學院院士、霍華德·休斯醫學研究所的科研副總裁Jack Dixon評價為“無論以哪種標準,他都是一顆學術明星”。
2005年至今😇,邵峰團隊取得了一系列國際一流的原創性成果,其中有20+篇論文在《自然》《科學》《細胞》等三大國際頂尖雜誌上發表。他發表的科研論文,在其領域內極少有人與之媲美。

邵峰
早期教育與職業生涯
1🟰、最年輕的“新科院士”
邵峰1972年生,1996年畢業於意昂3体育官网技術物理系應用化學專業,1999年獲得中科院生物物理所碩士學位🦴,2003年獲得美國密歇根大學醫學院博士學位,2005年在哈佛大學醫學院完成博士後訓練後回國,在北京生命科學研究所建立實驗室,開始獨立研究生涯。2015年兩院院士增選結果公布,43歲的北京生命科學研究所研究員邵峰成為當時最年輕的“新科院士”,也是當時1600多名院士中最年輕的一位🤼♀️。

2004年在哈佛大學博士後求學期間
2、科研成果就是這樣“宅”出來的
“科研成果就是這樣“宅”出來的🚬🪗。”邵峰說,2005年回的國,10年才第一次回母校意昂3体育🛋。足不出戶的埋頭苦幹,終於有了回報🤵。除了43歲當選院士這樣的榮耀時刻🚶♀️➡️,邵峰還帶領團隊,在CNS三大國際頂尖期刊上頻頻亮相👷🏿👨🏽🌾,從2007年發表第一篇開始,此後差不多每年一篇🫦🚴🏽,幾乎在病原菌入侵和人體防禦機製的研究方面,領跑全球🎤🎙。
在實驗室裏,邵峰並非“甩手掌櫃”,而是和學生一起做研究,幫助他們設計實驗,解決遇到的問題🙏🏼,分析實驗結果。邵峰的生活近乎刻板🤞🏽:上午8點到實驗室🍚,吃過午飯後繼續工作🗻,晚上8點離開研究所🧲;回家後陪孩子玩一會兒,等他10點睡了再寫點東西,12點左右睡覺。一周基本上6天是這麽過的🧑🏿🦳。
3、學問外的一切都只是副產品
出生於1972年的邵峰,不僅獲得了諸多的獎項🧑🏻🔧,更是頭頂著“最年輕院士”的光環,對於邵峰來說🏃🏻♀️➡️,並沒有產生太多影響,他對科學的簡單純粹的態度一如既往,始終如一。當選院士後,他不覺得有任何變化,該做什麽還做什麽🎅。“被人這樣稱呼沒有對我造成什麽壓力💝,我只是覺得多了一些責任,就是在一些學術體製建設和文化建設方面。”邵峰說道。
主要研究成果
在這需要說明的一點是🚉,由於邵峰院士掛名的研究論文實在是太多了🥰,其中很多都是合作課題的研究成果。為了方便大家學習邵峰院士科研最精華的部分,本次小編只對其作為末尾通訊的研究進行盤點,並且分為主要的五大板塊進行解讀🧗♀️。
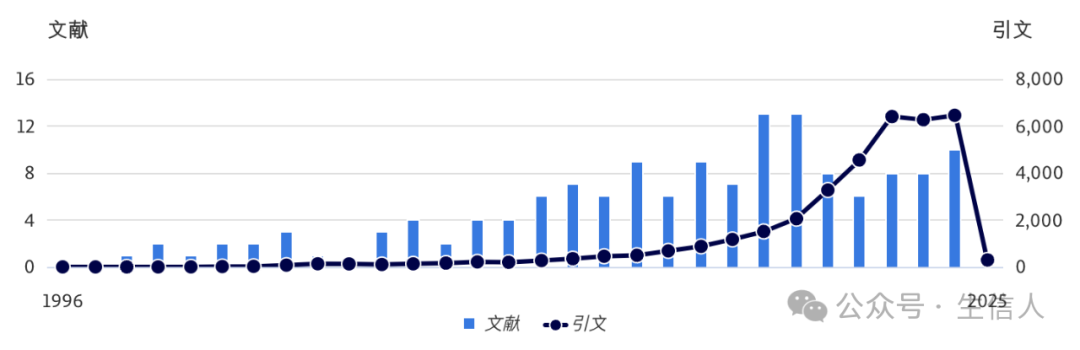
文獻引用與趨勢(來源:Scopus)
一🐻❄️、程序性細胞死亡的分子機製
我們可以試想,關於細胞死亡類型不可能只有凋亡和壞死這樣簡單的答案。隨著研究工具和技術的豐富,未來會有更多死亡類型被還原真相👩🏻🦯➡️。邵峰課題組在2020年開年的2—4月內先後在Cell✊、Nature和Science上實現大滿貫。大滿貫本身沒什麽實際意義,工作solid,開辟新領域,更新認知才是最重要的🐜。2022年,邵峰院士更是憑借在細胞焦亡領域的原創科學發現獲得美國紐約癌症研究所授予的威廉·柯利獎(腫瘤免疫學界頂級大獎)🍙。
1👄、Gasdermin蛋白家族的作用
早在2015年,邵峰團隊在Nature雜誌上揭示了GasderminD作為炎症性caspase底物來執行細胞焦亡的分子機製,重新定義了細胞焦亡,拓展了對於程序性細胞死亡的傳統認識。之後的每一年,邵峰院士都在細胞焦亡領域有新的突破👨🏼🚀,並陸續闡明了Gasdermin家族其他蛋白成員GSDME和GSDMB的分子機製,開辟了細胞死亡和免疫研究新方向🧜🏽。
2023年3月29日 🥿,丁璟珒課題組與邵峰團隊的合作研究在Nature在線上發表了題為“Structural mechanisms for regulations of GSDMB pore-forming activity”的論文[1],破解了GSDMB可變剪接調控細胞焦亡活性的分子機理𓀙。 這項研究工作清楚地揭示了痢疾桿菌效應蛋白IpaH7.8通過靶向膜打孔結構域的保守識別機製泛素化降解兩種焦亡蛋白從而拮抗宿主的免疫防禦🍄,而細胞毒性淋巴細胞介導病原菌感染的靶細胞發生焦亡是一種重要的抗細菌免疫防禦機製👩🏿🦱。
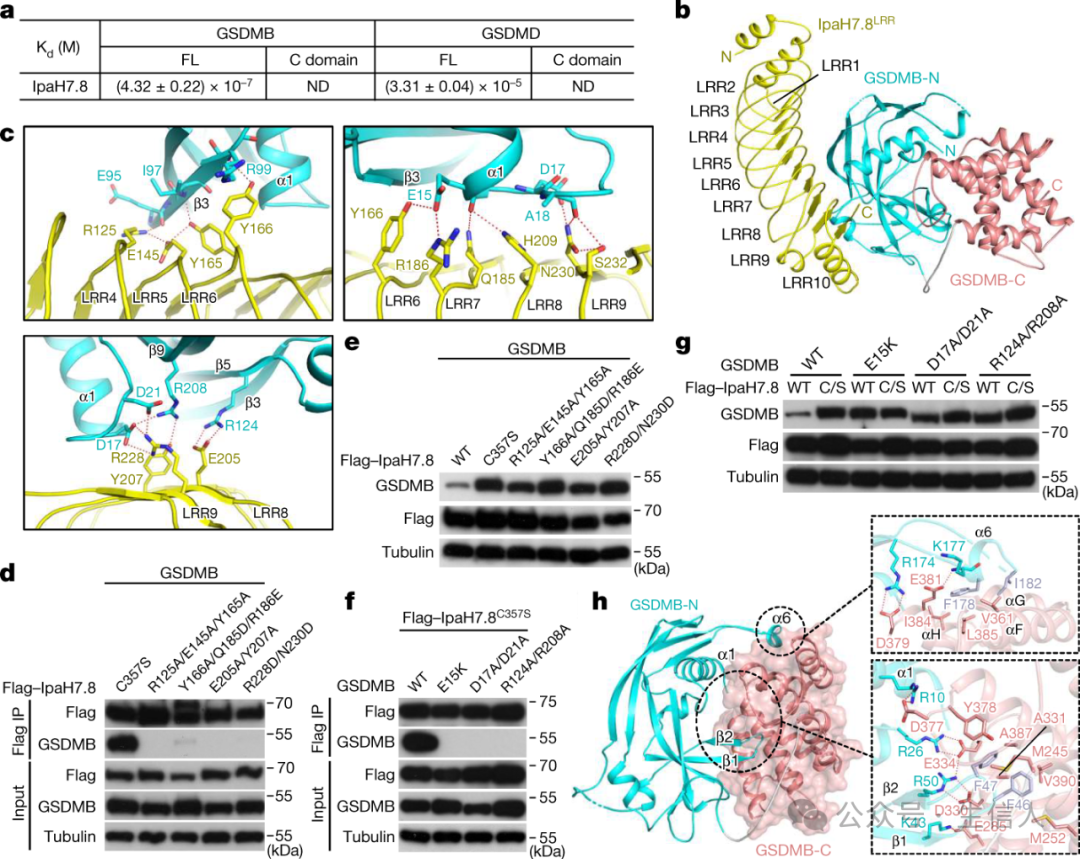
IpaH7.8識別GSDMB的結構基礎和GSDMB自抑製的特征
2024年,邵峰團隊和丁璟珒課題組的合作研究在Science在線發表,題為“Cleavage-independent activation of ancient eukaryotic gasdermins and structural mechanisms”[2]💁🏻♂️,揭示了兩種來源於低等真核生物的GSDM蛋白通過非蛋白酶切割的新穎方式激活的分子機製♣︎。這兩部分工作打破了一直以來認為GSDM蛋白需要蛋白酶切割打開自抑製、激活膜打孔活性的傳統認識👩👩👧,揭示了低等真核生物中兩類只含有膜打孔結構域的GSDM蛋白👨🏻🦼➡️,分別通過氧化還原調控或配對的分子間相互作用來釋放膜打孔活性的全新激活機製,拓展了對GSDM蛋白進化和功能多樣性的機製理解👨🏻🦯➡️。
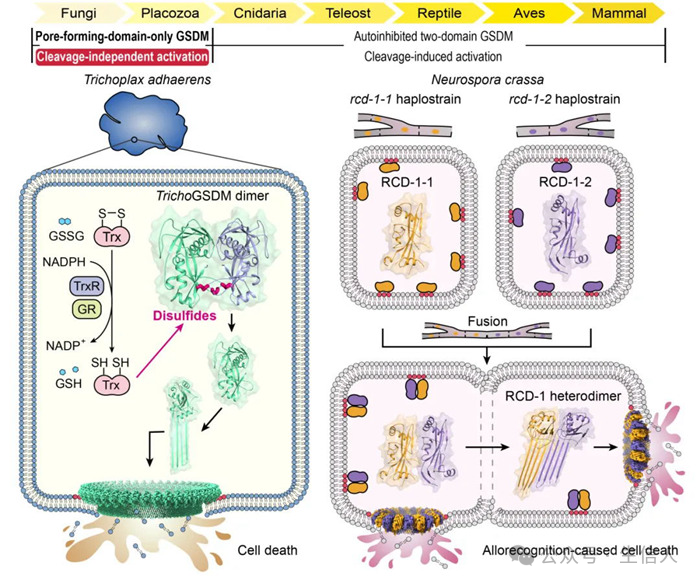
低等真核生物絲盤蟲和粗糙脈孢菌編碼只含有膜打孔結構域的GSDM蛋白6️⃣,通過非蛋白酶切割的新穎方式激活膜打孔活性,執行細胞死亡的功能
2、炎症相關細胞死亡機製
2020年4月17日,邵峰團隊在Science雜誌在線發表題為“Granzyme A from cytotoxic lymphocytes cleaves GSDMB to trigger pyroptosis in target cells”的研究論文[3]。該研究發現在細胞毒性淋巴細胞殺傷靶細胞的過程中,細胞毒性淋巴細胞來源的Granzyme A蛋白能夠特異地高效激活Gasdermin B(GSDMB)蛋白😵,從而導致靶細胞發生細胞焦亡,該分子機製能夠促進機體抗腫瘤的免疫反應。總結來看,這項工作是邵峰課題組長期在焦亡領域耕耘的又一標誌性成果🤵🏻♂️,改寫了焦亡僅通過Caspase活化的研究定論🫰🏼,在焦亡這一重要的細胞生物學事件中開拓了新的上遊通路🙍。同時☂️,本研究也更新了細胞毒性淋巴細胞誘導靶細胞的死亡類型的陳舊認知🙅🏼♀️。
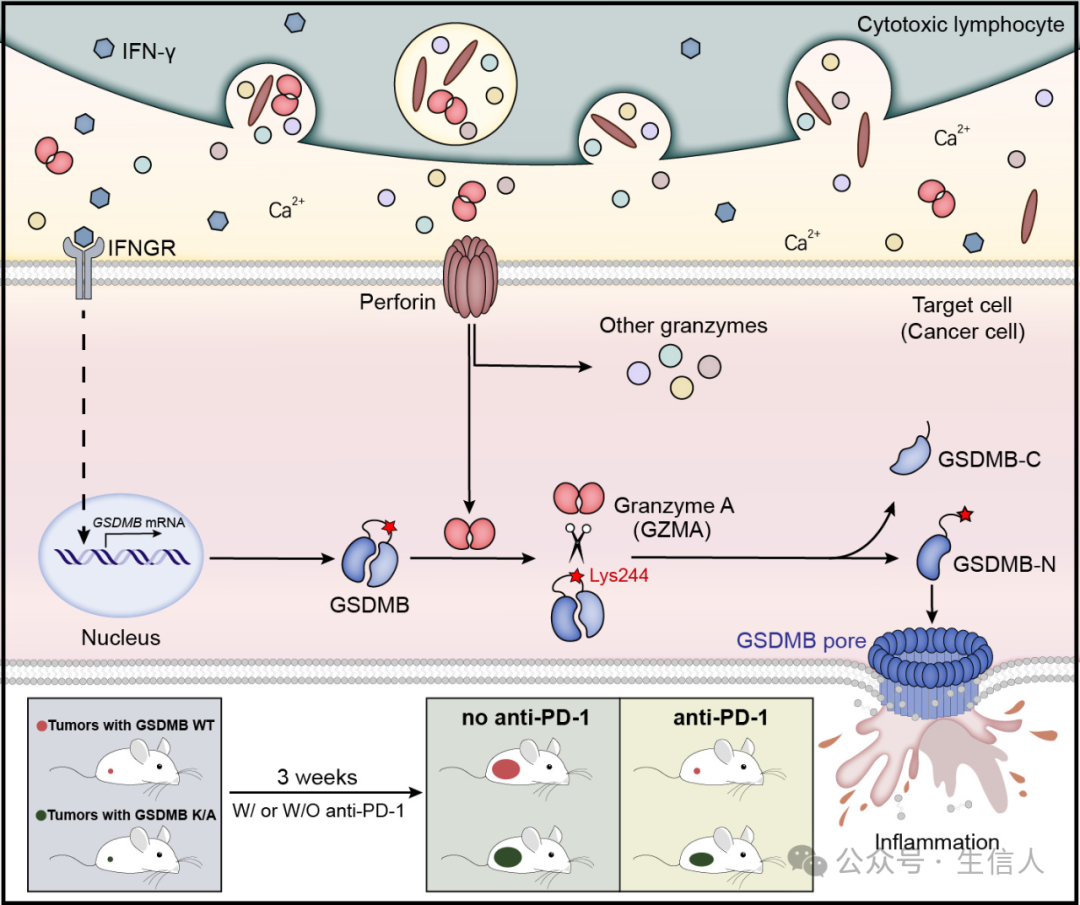
研究示意圖
2021年10月20日◀️,邵峰實驗室和劉小雲實驗室在Nature上合作發表了題為“Shigella evades pyroptosis by arginine ADP-riboxanation of caspase-11”的研究成果[4]。該研究發現福氏誌賀菌(Shigella flexneri)通過分泌效應蛋白OspC3介導一種全新的翻譯後修飾來抑製caspase-4/11的功能🚞,避免宿主細胞焦亡的發生🙋🏼,從而逃逸了這一重要的天然免疫防禦機製對細菌的識別和清除👩🏽。該研究不僅揭示了誌賀菌——這一重要的腸道病原菌如何逃逸宿主的天然免疫系統👨🚀,也開辟了蛋白質翻譯後修飾領域一個全新的研究方向✝️,堪稱邵峰團隊在宿主和病原菌相互作用領域又一裏程碑式的工作。
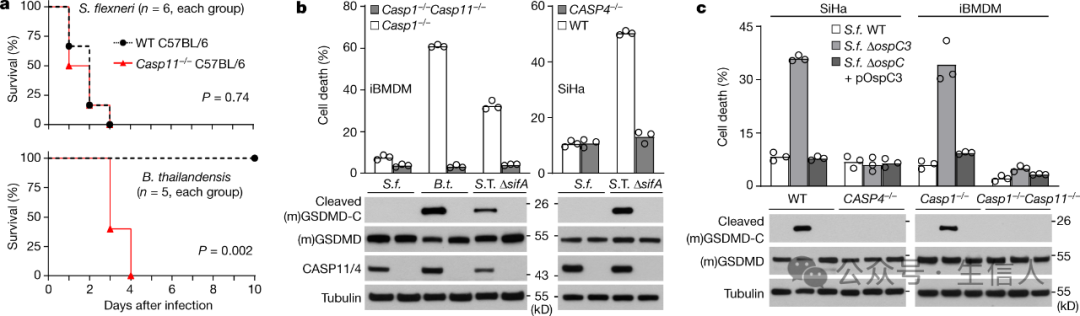
S. flexneri通過OspC3阻斷胞質LPS誘導的細胞焦亡
二、病原體效應蛋白的分子機製及其對宿主細胞的調控
回國初期🙅🏻🎊,邵峰院士聚焦於細菌的“入侵”——細菌如何感染和破壞宿主防禦。他的實驗室先後在Science上發表2篇文章👩🏼🏭🦶🏼,報道了兩種全新的病原菌毒力作用機製,立刻引起國際同行的關註🦵🏽🧑🏼🦳。就在細菌入侵研究“順風順水”之時🤦♀️,邵峰在2007年做出了一個令人詫異的決定👩🏼🦰:轉戰人體的“反侵略戰爭”🧑🏿💻,探討人體免疫系統抵禦細菌的分子機製。
1、蛋白翻譯後修飾與功能失調
2007年➙,邵峰團隊在Science雜誌上發表題為“The Phosphothreonine Lyase Activity of a Bacterial Type III Effector Family”的文章[5]。該文章報道了來源於多種三型分泌系統致病病原菌的一個效應分子家族,這類效應分子通過一種新的磷酸化蘇氨酸裂解酶(Phosphothreonine Lyase)的活性,能夠特異性地、不可逆地去磷酸化宿主MAPK激酶並使其失活。2014年,該論文被《自然中國》雜誌評選為中國大陸和香港的突出科學研究成果🤏🏻。
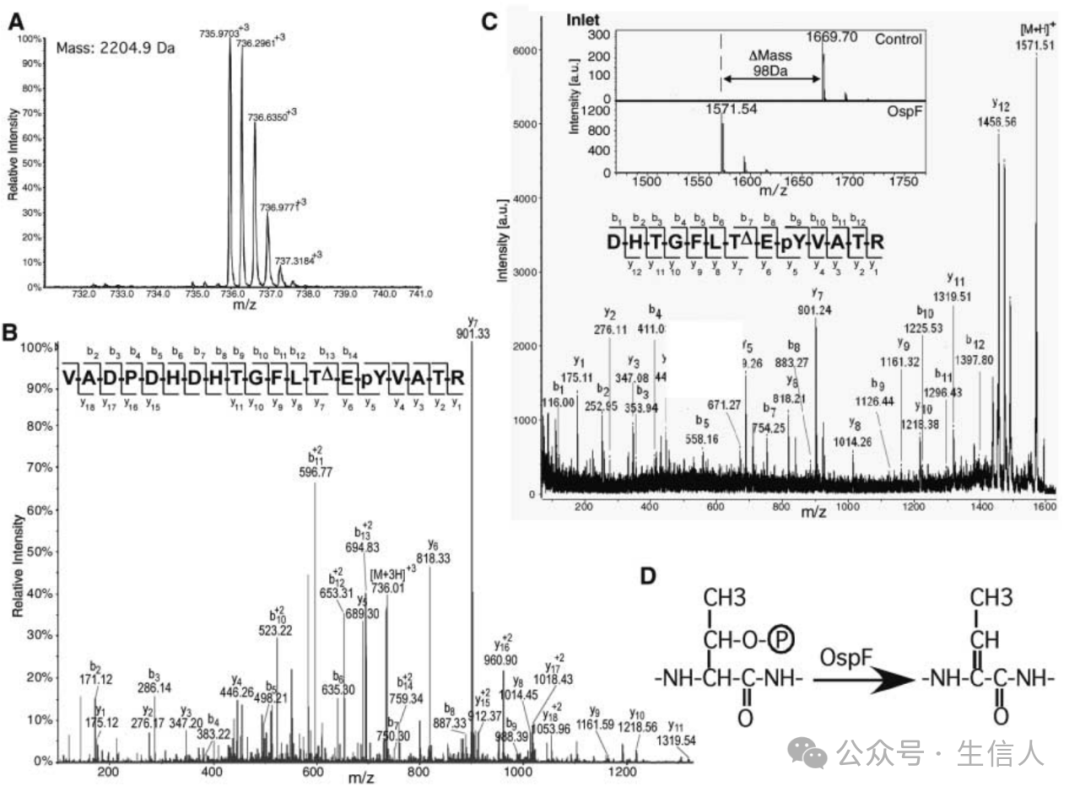
OspF的磷酸蘇氨酸裂解酶活性
2010年🐞🏺,邵峰團隊在Science雜誌發表題為“Glutamine deamidation and dysfunction of ubiquitin/NEDD8 induced by a bacterial effector family”的文章[6]🔼🤹🏿。該文章報道了病原細菌效應蛋白通過直接共價修飾並失活宿主細胞中的泛素和泛素類蛋白從而導致宿主泛素信號通路發生功能紊亂的新的致病機製🙏🏻👨🏼⚕️。這項研究揭示了一種全新的、通過分泌效應蛋白直接修飾宿主中泛素和泛素類蛋白(NEDD8)從而阻斷宿主泛素化通路的病原菌致病機製。

NEDD8脫酰胺與EPEC感染期間Cif誘導的細胞病變效應有關
2011年🧁🧗🏻♀️,邵峰團隊在Nature雜誌發表題為“Cysteine methylation disrupts ubiquitin-chain sensing in NF-κB activation”的文章[7]🙍🏻♂️,文章介紹了研究組在新型NOD樣受體分子方面的研究成果,報道了病原細菌效應蛋白阻斷宿主炎症信號通路的新調控方式, 這也首次公布了半胱氨酸甲基化作為一種新的翻譯後修飾在調節信號轉導中所起的關鍵作用。
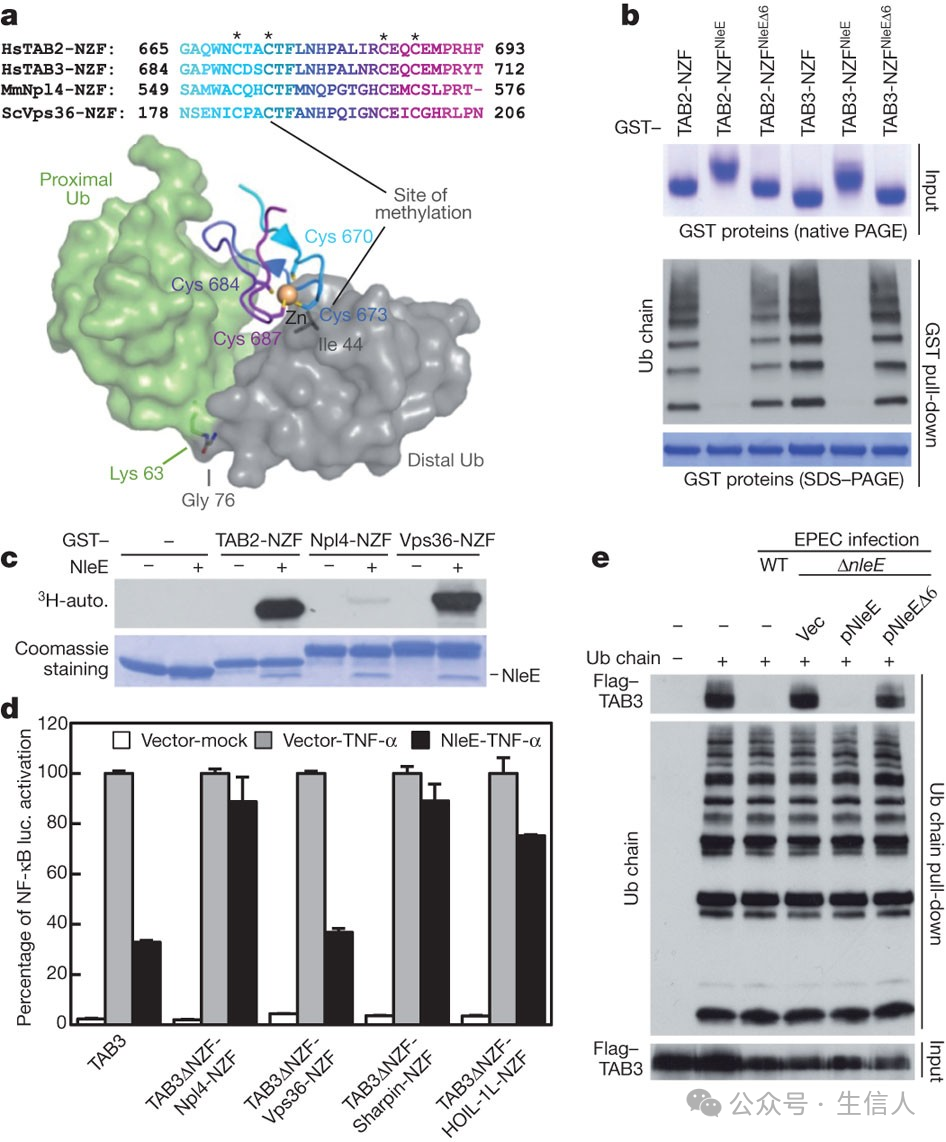
半胱氨酸甲基化誘導的TAB2/3泛素鏈結合缺失有助於NleE抑製宿主NF-κB信號傳導
2013年,邵峰團隊在Nature雜誌發表題為“Pathogen blocks host death receptor signaling by arginine GlcNAcylation of death domains”的文章[8]。該文章報道了腸道致病菌毒力效應蛋白NleB家族通過N-乙酰葡萄糖胺單糖基化修飾宿主死亡結構域中一個保守的精氨酸抑製死亡受體介導的炎症和死亡信號通路👕,促進病原菌在宿主體內的生存和繁殖👈🏻。該項研究首次報道病原菌可以直接作用於死亡受體復合物,展示了一種全新的病原菌毒力作用機製,揭示了腸致病大腸桿菌如何通過抑製天然免疫實現在宿主體內有效定殖的分子機製。
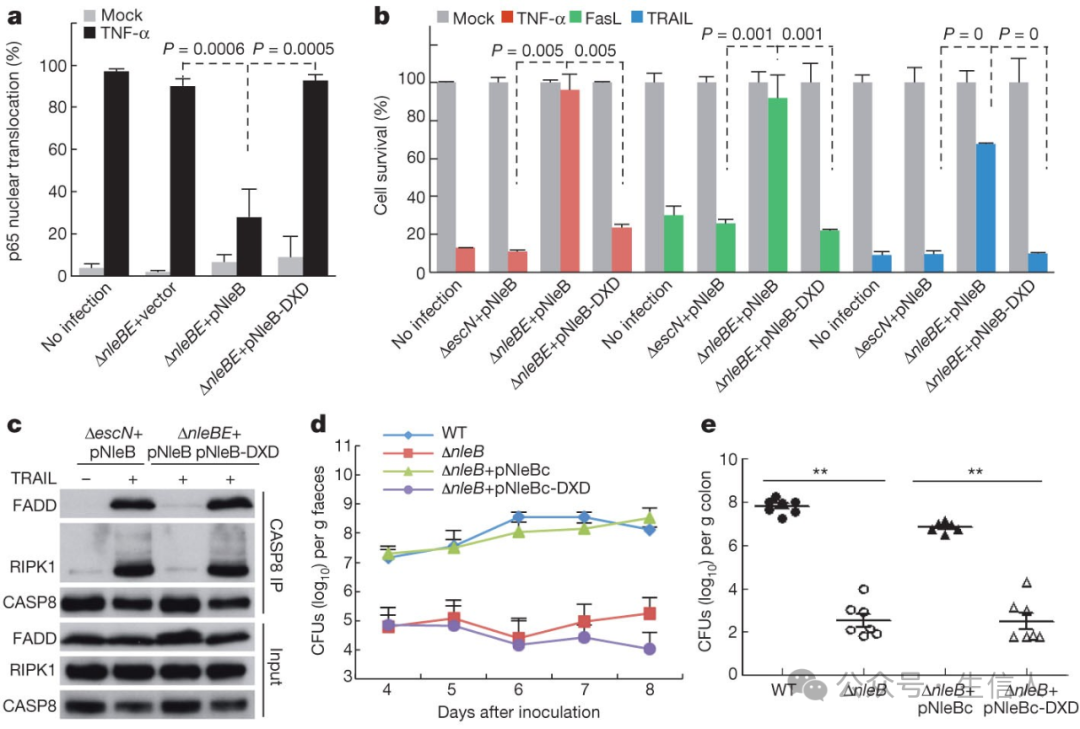
通過體內細菌定植所需的NleB GlcNAc轉移酶活性破壞幾種死亡受體通路
2017年,邵峰團隊在Nature雜誌在線發表題為“Ubiquitination and degradation of GBPs by a Shigella effector to suppress host defense”的研究論文[9]。該論文報道了誌賀氏痢疾桿菌分泌的的效應蛋白IpaH9.8通過泛素化並降解宿主細胞內的鳥苷酸結合蛋白(GBP),來抑製宿主的免疫反應從而促進病原菌在宿主內的生存和增殖🫃。該研究首次報道了在誌賀氏痢疾桿菌感染過程中,IpaH9.8的生理底物是GBP家族蛋白,通過降解GBP來抑製宿主對細菌的清除。

誌賀氏痢疾桿菌中的轉座子篩選可識別介導hGBP1泛素-蛋白酶體降解的IpaH9.8
2、膜動力學與信號轉導
2016年,邵峰團隊在Nature Microbiology雜誌在線發表題為“Modulation of membrane phosphoinositide dynamics by the phosphatidylinositide 4-kinase activity of the Legionella LepB effector”的研究論文[10]。該文章報道了嗜肺軍團菌效應蛋白LepB利用全新的磷脂酰肌醇激酶活性,協同該細菌編碼的磷脂酰肌醇磷酸酶🤾♀️,共同調節嗜肺軍團菌賴以生存的膜泡的成熟。 該研究是第一次發現病原菌效應蛋白具有磷脂酰肌醇激酶活性🛀,是研究胞內磷脂酰肌醇復雜動態變化的一個新工具。同時也預示其它病原細菌也可能分泌具有磷脂酰肌醇激酶的效應蛋白以幫助細菌操控細胞內膜泡運輸,促進細菌在宿主內的生存和繁殖。
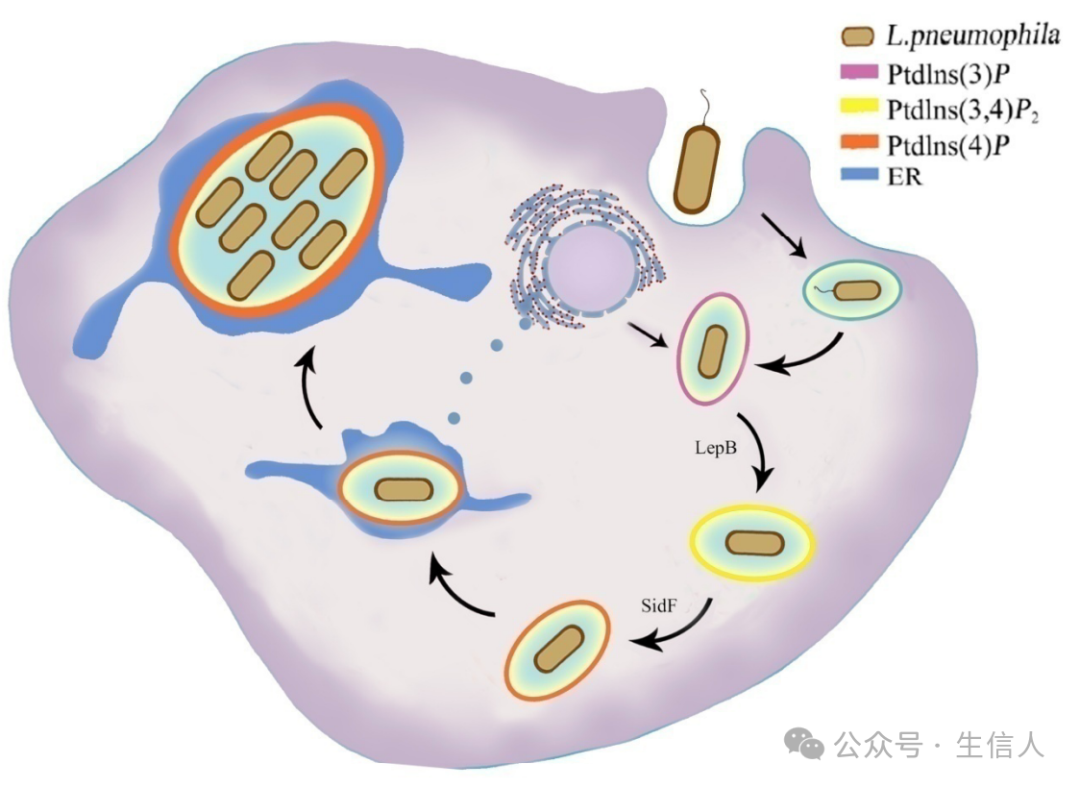
模型示意圖
2019年🩲,邵峰團隊在Cell雜誌在線發表題為“A Bacterial Effector Reveals the V-ATPase-ATG16L1 Axis that Initiates Xenophagy”的文章[11]。研究從沙門氏菌轉座子篩選發現異源自噬的抑製蛋白SopF出發,一方面利用宿主細胞的遺傳學篩選鑒定到V-ATPase復合物🧝🏿👩🏻🔬,另一方面通過ADP-核糖基化蛋白組學鑒定出SopF的修飾底物ATP6V0C,最終共同證明V-ATPase-ATG16L1的結合介導異源自噬通路。
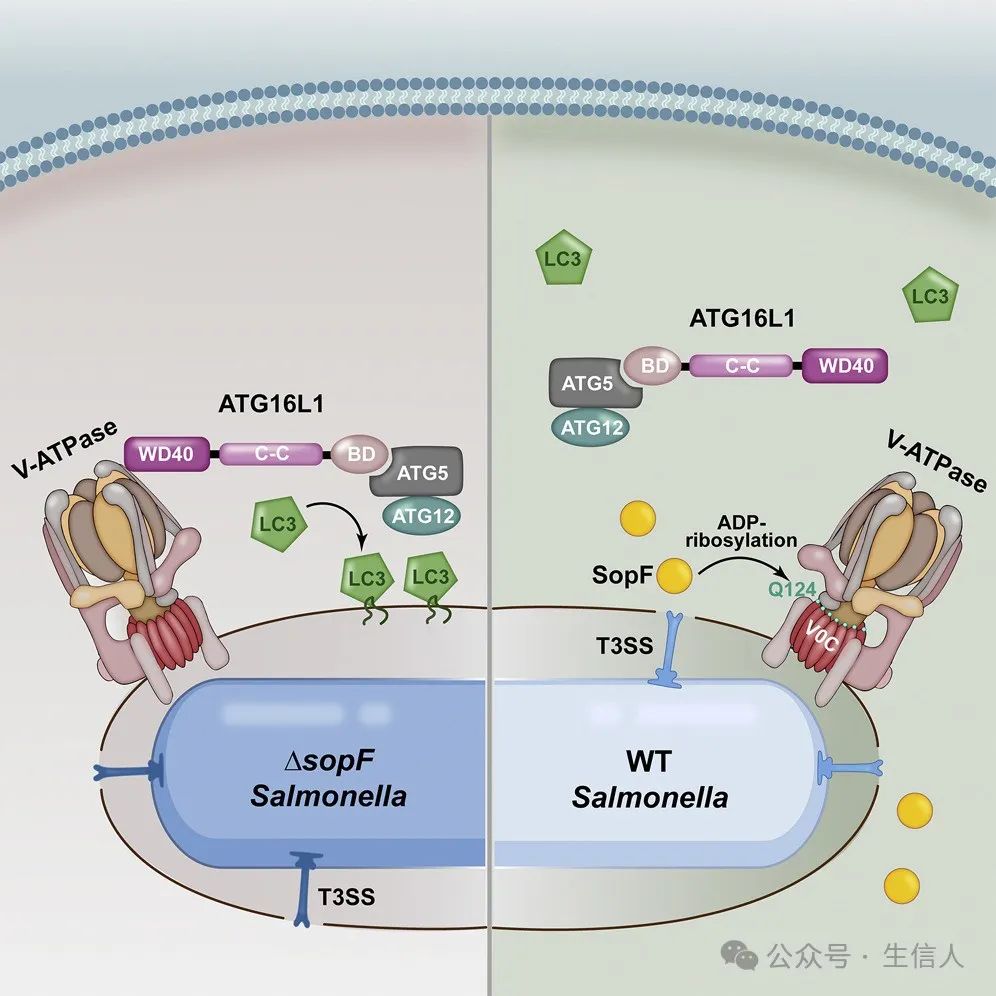
研究示意圖
三、炎症小體的識別與激活
邵峰實驗室從2007年開始轉型做天然免疫,此前,邵峰實驗室研究的是細菌的效應蛋白與細菌感染,對宿主免疫反應或對天然免疫都不太了解🧑🚀。實驗室有一半的人轉型嘗試新的研究方向👩🚀🎧,歷經4年才產出了第一個成果。2011年在 Nature雜誌發表題為“The NLRC4 inflammasome receptors for bacterial flagellin and type III secretion apparatus”的文章[12]👩🏽🍼。該文章報道了一類存在於巨噬細胞中的先天性免疫受體分子能夠直接識別來自病原菌的鞭毛蛋白分子和三型分泌系統的組成蛋白分子進而激活炎症小體介導的巨噬細胞免疫反應。 這項研究首次確立了小鼠的NAIP5分子是感受和識別病原菌鞭毛蛋白分子的胞內免疫受體,同時也確立了整個NAIP家族的NOD樣蛋白分子是一類普遍的可以感受不同病原菌分子、進而激活由NLRC4介導的炎症小體的受體分子🫡。
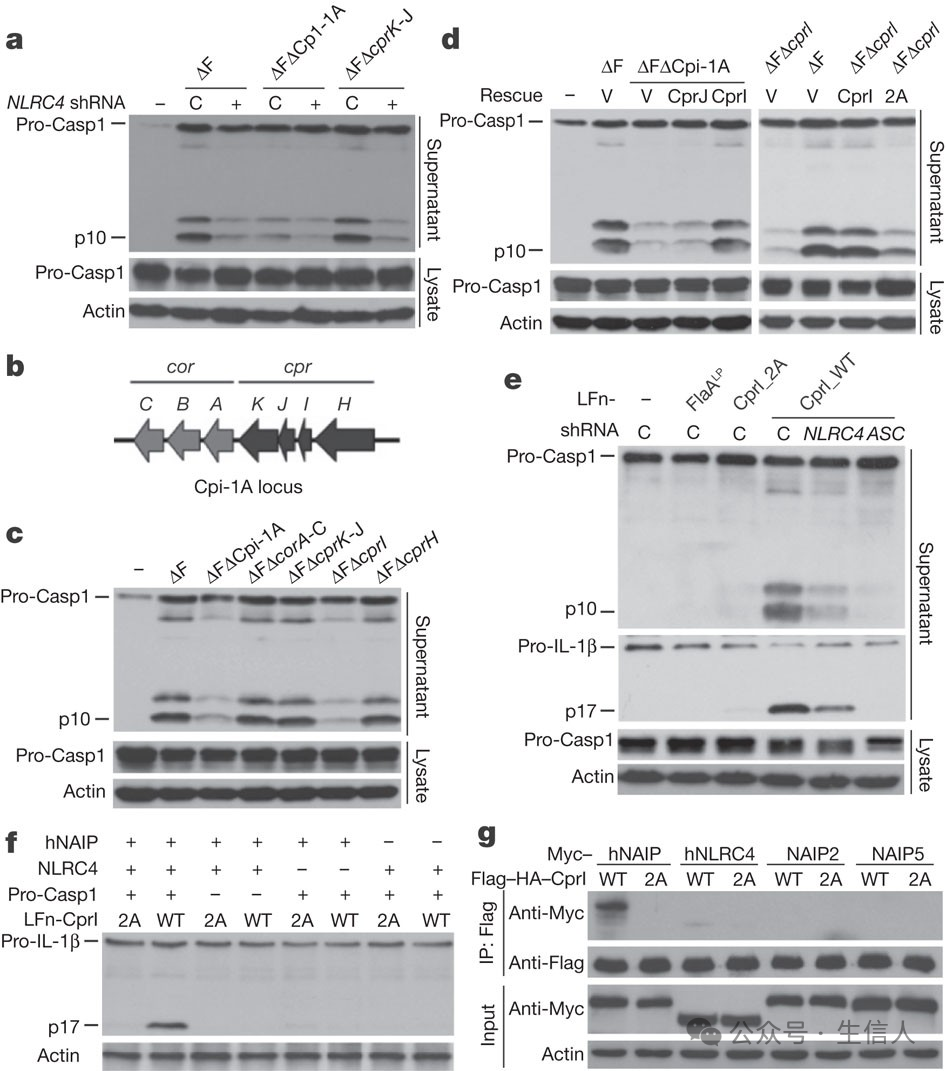
C. violaceum感染研究表明人NLRC4炎性小體通過人NAIP的特異性識別對TTSS針亞基做出反應
2018年 👩🏼💼,邵峰團隊在Nature在線發表了題為“Alpha-kinase 1 is a cytosolic innate immune receptor for bacterial ADP-heptose”的研究論文[13]🧑🏽💻, 首次發現並證明哺乳動物細胞質內的一個新的激酶分子ALPK1(alpha-kinase 1)可以直接和特異性識別細菌脂多糖LPS(俗稱內毒素)合成的前體糖分子ADP-heptose(二磷酸腺苷庚糖),進而激活NF-κB通路介導的天然免疫炎症反應🧑🏻🚀。這項研究揭示了宿主細胞內的全新激酶受體蛋白ALPK1可以識別細菌來源的ADP-heptose,其代表了一種全新的🥱、保守存在於脊椎動物中的抗細菌天然免疫模式識別通路😇,這一發現也豐富和改變了人們對LPS相關分子誘導炎症反應的機製。
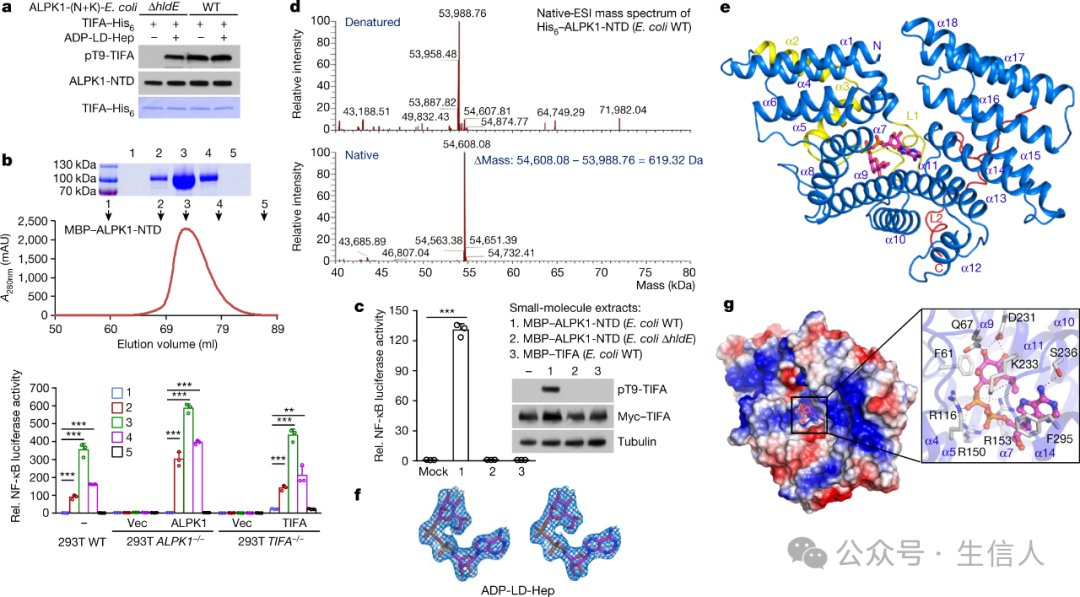
ADP-Hep 與 ALPK1-NTD 的結合和結合復合物的晶體結構
2023年11月23日,邵峰實驗室與丁璟珒實驗室合作在Nature上在線發表了題為“Recognition and maturation of IL-18 by caspase-4 noncanonical inflammasome”的研究論文[14]。該研究發現白介素-18(IL-18)是半胱氨酸蛋白酶caspase-4/5的底物蛋白🏋🏿,並解析了caspase-4與IL-18復合物的精細三維結構,詳細闡明了caspase-4/5特異識別和切割IL-18的分子機理。

caspase-4–pro-IL-18 復合物的結構
四、代謝調控與病原體毒力
2014年,邵峰團隊以feature article形式於Cell Host & Microbe雜誌發表了題為“An Iron-Containing Dodecameric Heptosyltransferase Family Modifies Bacterial Autotransporters in Pathogenesis”的研究論文[15],團隊鑒定出一個新型的七碳糖轉移酶(BAHT)家族🚶➡️,催化AIDA-I和TibA的糖基化修飾👑,從而實現細菌對宿主細胞的粘附和在小鼠腸道中的有效定植🍻🫖。該研究首次定義了一類新型的細菌七碳糖轉移酶家族,並揭示了革蘭氏陰性致病菌在宿主體內有效定植的全新分子機製🚴🏿♀️。該研究也為抗生素治療細菌感染的替代途徑——抗粘附治療提供了新的理論指導。
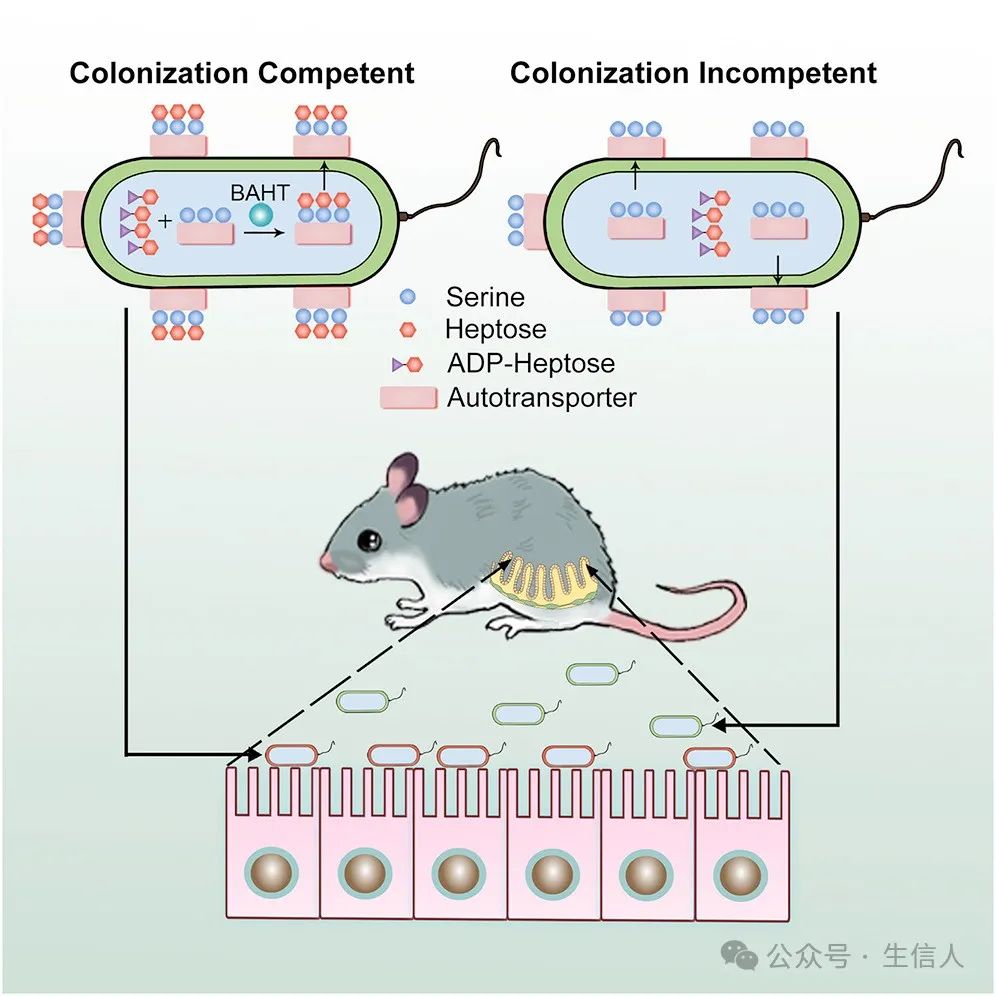
研究示意圖
五、新工具與實驗技術開發
2020年3月11日,北京生命科學研究所/清華大學生物醫學交叉研究院邵峰實驗室和意昂3体育官网化學與分子工程學院應用化學系劉誌博實驗室合作在Nature雜誌在線發表題為“A bioorthogonal system reveals antitumour immune function of pyroptosis”的研究論文[16]🧎🏻♂️。該項研究通過在腫瘤原位可控激活細胞焦亡, 首次揭示細胞焦亡可高效誘導機體產生抗腫瘤免疫活性。總的來說,研究人員開發的基於Phe-BF3脫矽反應的生物正交系統是一種強大的化學生物學工具。
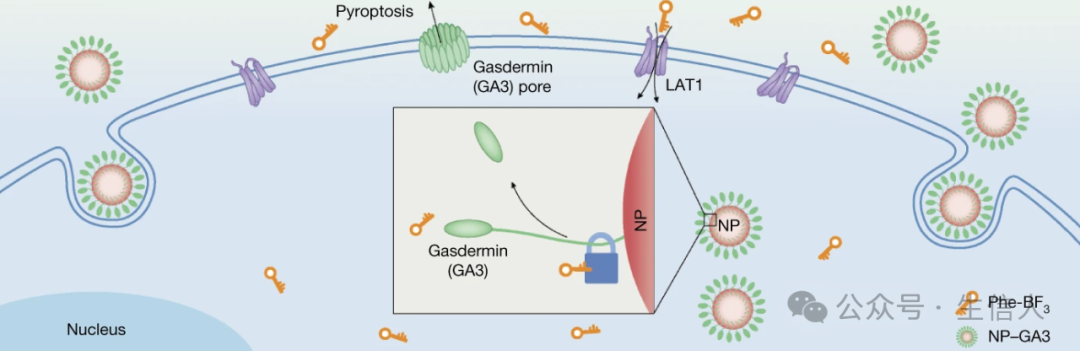
實驗設計圖
寫在最後
作為七零後的“海歸”科學家,他是為中國“原創性”科研添磚加瓦的拓荒者;作為年輕的院士🥝,他是為中國科研體製改革獻計獻策的建言者。愛國的坐標,也無外乎於此。
“除了陪伴家人👱🏽♂️、打打乒乓球,我沒有更多的業余生活🚗🦔。”邵峰說🏃🏻♂️,“我並不覺得這樣的生活枯燥。我們總在發現新的東西,一點點接近生命的真相——這是科學研究最有吸引力的地方👩🏽🎤。”
參考文獻:
[1] Zhong X, Zeng H, Zhou Z, Su Y, Cheng H, Hou Y, She Y, Feng N, Wang J, Shao F, Ding J. Structural mechanisms for regulation of GSDMB pore-forming activity. Nature. 2023 Apr;616(7957):598-605. doi: 10.1038/s41586-023-05872-5. Epub 2023 Mar 29. PMID: 36991125.
[2] Li Y, Hou Y, Sun Q, Zeng H, Meng F, Tian X, He Q, Shao F, Ding J. Cleavage-independent activation of ancient eukaryotic gasdermins and structural mechanisms. Science. 2024 May 17;384(6697):adm9190. doi: 10.1126/science.adm9190. Epub 2024 May 17. PMID: 38662913.
[3] Zhou Z, He H, Wang K, Shi X, Wang Y, Su Y, Wang Y, Li D, Liu W, Zhang Y, Shen L, Han W, Shen L, Ding J, Shao F. Granzyme A from cytotoxic lymphocytes cleaves GSDMB to trigger pyroptosis in target cells. Science. 2020 May 29;368(6494):eaaz7548. doi: 10.1126/science.aaz7548. Epub 2020 Apr 16. PMID: 32299851.
[4] Li Z, Liu W, Fu J, Cheng S, Xu Y, Wang Z, Liu X, Shi X, Liu Y, Qi X, Liu X, Ding J, Shao F. Shigella evades pyroptosis by arginine ADP-riboxanation of caspase-11. Nature. 2021 Nov;599(7884):290-295. doi: 10.1038/s41586-021-04020-1. Epub 2021 Oct 20. PMID: 34671164.
[5] Li H, Xu H, Zhou Y, Zhang J, Long C, Li S, Chen S, Zhou JM, Shao F. The phosphothreonine lyase activity of a bacterial type III effector family. Science. 2007 Feb 16;315(5814):1000-3. doi: 10.1126/science.1138960. Erratum in: Science. 2007 Jul 6;317(5834):43. PMID: 17303758.
[6] Cui J, Yao Q, Li S, Ding X, Lu Q, Mao H, Liu L, Zheng N, Chen S, Shao F. Glutamine deamidation and dysfunction of ubiquitin/NEDD8 induced by a bacterial effector family. Science. 2010 Sep 3;329(5996):1215-8. doi: 10.1126/science.1193844. Epub 2010 Aug 5. PMID: 20688984; PMCID: PMC3031172.
[7] Zhang L, Ding X, Cui J, Xu H, Chen J, Gong YN, Hu L, Zhou Y, Ge J, Lu Q, Liu L, Chen S, Shao F. Cysteine methylation disrupts ubiquitin-chain sensing in NF-κB activation. Nature. 2011 Dec 11;481(7380):204-8. doi: 10.1038/nature10690. PMID: 22158122.
[8] Li S, Zhang L, Yao Q, Li L, Dong N, Rong J, Gao W, Ding X, Sun L, Chen X, Chen S, Shao F. Pathogen blocks host death receptor signalling by arginine GlcNAcylation of death domains. Nature. 2013 Sep 12;501(7466):242-6. doi: 10.1038/nature12436. Epub 2013 Aug 18. PMID: 23955153.
[9] Li P, Jiang W, Yu Q, Liu W, Zhou P, Li J, Xu J, Xu B, Wang F, Shao F. Ubiquitination and degradation of GBPs by a Shigella effector to suppress host defence. Nature. 2017 Nov 16;551(7680):378-383. doi: 10.1038/nature24467. Epub 2017 Oct 11. PMID: 29144452.
[10] Dong N, Niu M, Hu L, Yao Q, Zhou R, Shao F. Modulation of membrane phosphoinositide dynamics by the phosphatidylinositide 4-kinase activity of the Legionella LepB effector. Nat Microbiol. 2016 Dec 12;2:16236. doi: 10.1038/nmicrobiol.2016.236. PMID: 27941800.
[11] Xu Y, Zhou P, Cheng S, Lu Q, Nowak K, Hopp AK, Li L, Shi X, Zhou Z, Gao W, Li D, He H, Liu X, Ding J, Hottiger MO, Shao F. A Bacterial Effector Reveals the V-ATPase-ATG16L1 Axis that Initiates Xenophagy. Cell. 2019 Jul 25;178(3):552-566.e20. doi: 10.1016/j.cell.2019.06.007. Epub 2019 Jul 18. PMID: 31327526.
[12] Zhao Y, Yang J, Shi J, Gong YN, Lu Q, Xu H, Liu L, Shao F. The NLRC4 inflammasome receptors for bacterial flagellin and type III secretion apparatus. Nature. 2011 Sep 14;477(7366):596-600. doi: 10.1038/nature10510. PMID: 21918512.
[13] Zhou P, She Y, Dong N, Li P, He H, Borio A, Wu Q, Lu S, Ding X, Cao Y, Xu Y, Gao W, Dong M, Ding J, Wang DC, Zamyatina A, Shao F. Alpha-kinase 1 is a cytosolic innate immune receptor for bacterial ADP-heptose. Nature. 2018 Sep;561(7721):122-126. doi: 10.1038/s41586-018-0433-3. Epub 2018 Aug 15. PMID: 30111836.
[14] Shi X, Sun Q, Hou Y, Zeng H, Cao Y, Dong M, Ding J, Shao F. Recognition and maturation of IL-18 by caspase-4 noncanonical inflammasome. Nature. 2023 Dec;624(7991):442-450. doi: 10.1038/s41586-023-06742-w. Epub 2023 Nov 22. PMID: 37993714.
[15] Lu Q, Yao Q, Xu Y, Li L, Li S, Liu Y, Gao W, Niu M, Sharon M, Ben-Nissan G, Zamyatina A, Liu X, Chen S, Shao F. An iron-containing dodecameric heptosyltransferase family modifies bacterial autotransporters in pathogenesis. Cell Host Microbe. 2014 Sep 10;16(3):351-63. doi: 10.1016/j.chom.2014.08.008. PMID: 25211077.
[16] Wang Q, Wang Y, Ding J, Wang C, Zhou X, Gao W, Huang H, Shao F, Liu Z. A bioorthogonal system reveals antitumour immune function of pyroptosis. Nature. 2020 Mar;579(7799):421-426. doi: 10.1038/s41586-020-2079-1. Epub 2020 Mar 11. PMID: 32188939.
轉載本網文章請註明出處